I follicoli linfoidi formati in un chip d'organo microfluidico replicano le funzioni immunitarie umane e le risposte al vaccino in vitro
Di Lindsay Brownell - wyss.harvard.edu
(BOSTON) – Per citare le parole semplici ma estremamente accurate del veterano scrittore scientifico Ed Yong in The Atlantic , “Il sistema immunitario è molto complicato”. Come la pandemia di COVID-19 aveva ampiamente chiarito, la scienza non comprende ancora appieno i sofisticati meccanismi di difesa che ci proteggono dagli invasori microbici. Perché alcune persone non mostrano sintomi quando vengono infettate da SARS-CoV-2 mentre altre soffrono di forti febbri e dolori muscolari? Perché alcuni soccombono alle tempeste di citochine create dall'organismo stesso? Ci mancano ancora risposte esatte a queste domande.
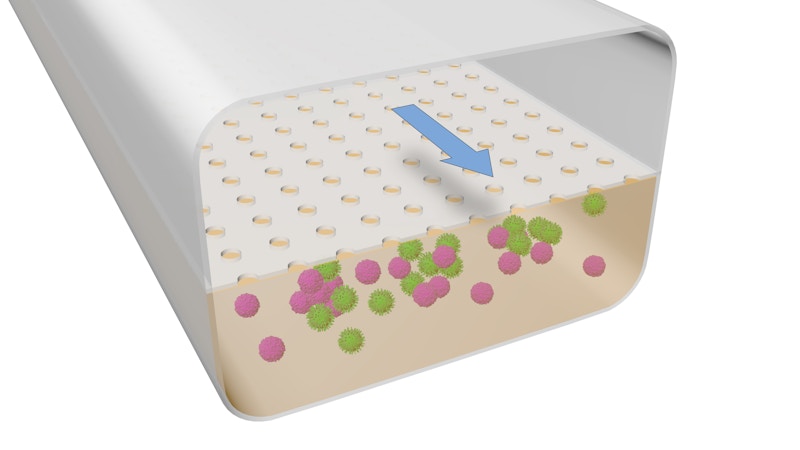
Gli scienziati di oggi, tuttavia, ora hanno un nuovo strumento per aiutarli a svelare i misteri del sistema immunitario, grazie a un gruppo di ricercatori del Wyss Institute for Biologically Inspired Engineering dell'Università di Harvard. Hanno coltivato cellule B e T umane all'interno di un dispositivo microfluidico Organ Chip e li hanno persuasi a formare spontaneamente follicoli linfoidi funzionali, strutture che risiedono nei linfonodi e in altre parti del corpo umano che mediano le risposte immunitarie. Sono costituiti da diverse camere che ospitano cellule B e cellule T "naive", che insieme danno inizio alla cascata di eventi che porta a una risposta immunitaria completa quando vengono esposte a un antigene specifico.
Oltre a consentire ai ricercatori di sondare la normale funzione del sistema immunitario, questi chip del follicolo linfoide (LF) possono anche essere utilizzati per prevedere le risposte immunitarie a vari vaccini e aiutare a selezionare i migliori risultati, offrendo un miglioramento significativo rispetto ai modelli preclinici esistenti come le cellule in un piatto e primati non umani. Il risultato è riportato oggi in Advanced Science .
“Gli animali sono stati i modelli di ricerca di riferimento per lo sviluppo e la sperimentazione di nuovi vaccini, ma il loro sistema immunitario differisce in modo significativo dal nostro e non prevede con precisione come risponderanno gli esseri umani. Il nostro chip LF offre un modo per modellare la complessa coreografia delle risposte immunitarie umane alle infezioni e alla vaccinazione e potrebbe accelerare significativamente il ritmo e la qualità della creazione del vaccino in futuro", ha affermato il primo autore Girija Goyal , Ph.D., Senior Staff Scientist presso il Wyss Institute.
Una scoperta accidentale
Come molte grandi scoperte scientifiche, il progetto LF Chip è il risultato di una serendipità in laboratorio. Goyal e altri scienziati del Wyss Institute volevano studiare come le cellule B e T circolanti nel sangue avrebbero cambiato il loro comportamento una volta entrati in un tessuto, quindi hanno ottenuto quelle cellule da campioni di sangue umano e le hanno coltivate all'interno di un dispositivo microfluidico Organ Chip per replicare il fisico condizioni che sperimenterebbero quando incontrassero un organo.
Quando le cellule sono state collocate all'interno di uno dei due canali all'interno del dispositivo, non è successo nulla di straordinario, ma quando i ricercatori hanno avviato il flusso del mezzo di coltura attraverso l'altro canale per nutrire le cellule, sono rimasti sorpresi nel vedere che le cellule B e T hanno iniziato di auto-organizzarsi spontaneamente in strutture 3D all'interno dell'Organ Chip che sembravano simili a "centri germinali" - strutture all'interno di LF dove si verificano complesse reazioni immunitarie. "È stato così inaspettato che ci siamo completamente spostati dall'esperimento originale e ci siamo concentrati sul tentativo di capire cosa fossero", ha detto Goyal.
Quando i ricercatori hanno iniziato a sondare le misteriose strutture che si erano formate all'interno dell'Organ Chip in condizioni di flusso, hanno scoperto che le cellule stavano secernendo una sostanza chimica chiamata CXCL13. CXCL13 è un segno distintivo della formazione di LF, sia all'interno dei linfonodi che in altre parti del corpo in risposta all'infiammazione cronica, come nel cancro e nelle condizioni autoimmuni.
Il team ha anche scoperto che i linfociti B all'interno degli LF che si sono autoassemblati su chip esprimono anche un enzima chiamato citidina deaminasi indotta dall'attivazione (AID), che è fondamentale per attivare i linfociti B contro antigeni specifici e non è presente nei linfociti B che sono circolante nel sangue. Né CXCL13 né AID erano presenti nelle cellule coltivate in un piatto 2D standard, suggerendo che gli scienziati avevano effettivamente creato con successo LF funzionali dalle cellule del sangue circolanti.
Nelle LF nel corpo umano, le cellule B attivate maturano e si differenziano in più tipi di cellule della progenie comprese le plasmacellule, che secernono grandi quantità di anticorpi contro un patogeno specifico. Il team ha rilevato la presenza di plasmacellule nei chip LF dopo aver applicato diversi stimoli utilizzati in laboratorio per attivare le cellule B, come la combinazione della citochina IL-4 e un anticorpo anti-CD40, o batteri morti. Sorprendentemente, le plasmacellule erano concentrate in cluster all'interno degli LF, come sarebbero in vivo.
"Questi risultati sono stati particolarmente interessanti perché hanno confermato che avevamo un modello funzionale che poteva essere utilizzato per svelare alcune delle complessità del sistema immunitario umano, comprese le sue risposte a più tipi di agenti patogeni", ha affermato Pranav Prabhala , un tecnico del Wyss Istituto e secondo autore dell'articolo.
Prevedere l'efficacia del vaccino su un chip
Ora che gli scienziati avevano un modello LF funzionale in grado di avviare una risposta immunitaria, hanno esplorato se il loro chip LF potesse essere utilizzato per replicare e studiare la risposta del sistema immunitario umano ai vaccini.
Nel corpo umano, la vaccinazione induce cellule speciali chiamate cellule dendritiche ad assorbire il patogeno iniettato e migrare verso i linfonodi, dove ne presentano frammenti sulla superficie. Lì, queste cellule presentanti l'antigene attivano le cellule B con l'assistenza delle cellule T locali nella LF, facendo sì che le cellule B si differenzino in plasmacellule che producono anticorpi contro il patogeno. Per replicare questo processo, i ricercatori hanno aggiunto cellule dendritiche ai chip LF insieme a cellule B e T di quattro donatori umani separati. Hanno quindi inoculato i chip con un vaccino contro il ceppo influenzale H5N1 insieme a un adiuvante chiamato SWE che è noto per aumentare le risposte immunitarie al vaccino.
Il nostro chip LF offre un modo per modellare la complessa coreografia delle risposte immunitarie umane alle infezioni e alla vaccinazione e potrebbe accelerare significativamente il ritmo e la qualità della creazione del vaccino in futuro.
I chip LF che hanno ricevuto il vaccino e l'adiuvante hanno prodotto significativamente più plasmacellule e anticorpi anti-influenzali rispetto ai linfociti B e T cresciuti in colture 2D o ai chip LF che hanno ricevuto il vaccino ma non l'adiuvante.
Il team ha quindi ripetuto l'esperimento con cellule di otto diversi donatori, questa volta utilizzando il vaccino antinfluenzale Fluzone Ⓡ disponibile in commercio , che protegge da tre diversi ceppi del virus nell'uomo. Ancora una volta, plasmacellule e anticorpi anti-influenzali erano presenti in numero significativo nei chip LF trattati. Hanno anche misurato i livelli di quattro citochine nei chip LF vaccinati che sono noti per essere secreti dalle cellule immunitarie attivate e hanno scoperto che i livelli di tre di esse (IFN-γ, IL-10 e IL-2) erano simili a quelli trovati nel siero di esseri umani che erano stati vaccinati con Fluzone Ⓡ .
I ricercatori Wyss stanno ora utilizzando i loro chip LF per testare vari vaccini e adiuvanti in collaborazione con aziende farmaceutiche e la Gates Foundation.
“La raffica di sforzi per lo sviluppo del vaccino innescata dalla pandemia di COVID-19 è stata impressionante per la loro velocità, ma l'aumento della domanda ha improvvisamente reso i modelli animali tradizionali scarse risorse. Il chip LF offre un modello più economico, più veloce e più predittivo per lo studio delle risposte immunitarie umane sia alle infezioni che ai vaccini, e speriamo che semplificherà e migliorerà lo sviluppo di vaccini contro molte malattie in futuro", ha affermato l'autore corrispondente Donald Ingber , MD, Ph.D., che è il direttore fondatore del Wyss Institute, nonché il Judah Folkman Professor of Vascular Biology presso la Harvard Medical School (HMS) e il Boston Children's Hospital, e Professore di Bioingegneria presso la Harvard John A. Paulson School of Engineering e Scienze Applicate.
Altri autori dell'articolo includono Yunhao Zhai, Min Sun Kim, Aditya Patil, Danielle Curran, Jaclyn Long, Abidemi Junaid e Tom Ferrante del Wyss Institute; Bruce Bausk, Tal Gilboa, Limor Cohen e David Walt del Wyss Institute, Brigham and Women's Hospital e HMS; ed ex membri del Wyss Institute Gautam Mahajan, Liangxia Xie, Roey Lazarovits, Adam Mansour, Sanjay Sharma, Oren Levy e Rachelle Prantil-Baun.
Questa ricerca è stata supportata dalla DARPA con il numero di accordo cooperativo W911NF-12-2-0036, dal National Institutes of Health con la concessione UG3HL141797, dalla Bill and Melinda Gates Foundation, dalla BARDA con il contratto 75A50121C00075 e dal Wyss Institute for Biologically Inspired Engineering.


Posta un commento
Condividi la tua opinione nel rispetto degli altri. Link e materiale non pertinente sarà eliminato.