La Food and Drug Administration (FDA) giovedì mattina ha rilasciato un'autorizzazione d'uso d'emergenza per la pillola antivirale di Merck per COVID-19, più di 12 ore dopo aver dato il via libera per un simile farmaco orale prodotto da Pfizer.
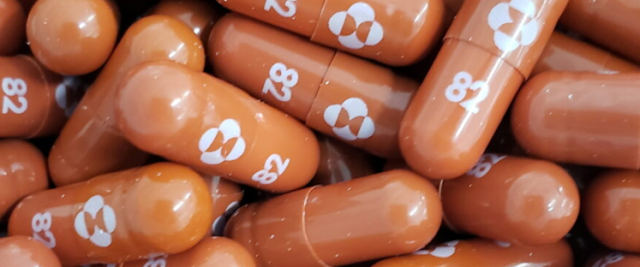
Il farmaco di Merck, chiamato molnupiravir, è stato sviluppato con Ridgeback Biotherapeutics, e ha dimostrato di ridurre le ospedalizzazioni e i decessi dal 9,7 per cento al 6,8 per cento negli studi clinici di individui ad alto rischio, secondo il regolatore federale del farmaco.
Il farmaco è progettato per trattare gli adulti che sono ad alto rischio di ammalarsi gravemente di COVID-19, la malattia causata dal virus cinese. Il farmaco orale può anche essere usato nel trattamento di casi da lievi a moderati di COVID-19 negli adulti e per i quali trattamenti alternativi di COVID-19 non sono accessibili o non sono clinicamente appropriati, ha detto l'agenzia.
"Poiché continuano ad emergere nuove varianti del virus, è cruciale espandere l'arsenale nazionale di terapie COVID-19 utilizzando l'autorizzazione all'uso di emergenza", ha detto Patrizia Cavazzoni, direttore del Center for Drug Evaluation and Research della FDA, in una dichiarazione.
E l'autorizzazione di emergenza di giovedì "fornisce un'ulteriore opzione di trattamento contro il virus COVID-19 sotto forma di una pillola che può essere presa per via orale", ha continuato Cavazzoni nella sua dichiarazione.
Il 30 novembre, il comitato consultivo della FDA ha votato 13-10 per raccomandare il farmaco tra le preoccupazioni sulla sua efficacia e sicurezza. Il farmaco non può essere autorizzato per l'uso in pazienti di età inferiore ai 18 anni perché il molnupiravir potrebbe avere un impatto sulla crescita delle ossa e della cartilagine, secondo la FDA.
Le autorità hanno detto che un vantaggio dei farmaci orali di Pfizer e Merck è che possono essere presi a casa e non richiedono un'iniezione o una flebo in una clinica medica o in ospedale.

Posta un commento
Condividi la tua opinione nel rispetto degli altri. Link e materiale non pertinente sarà eliminato.