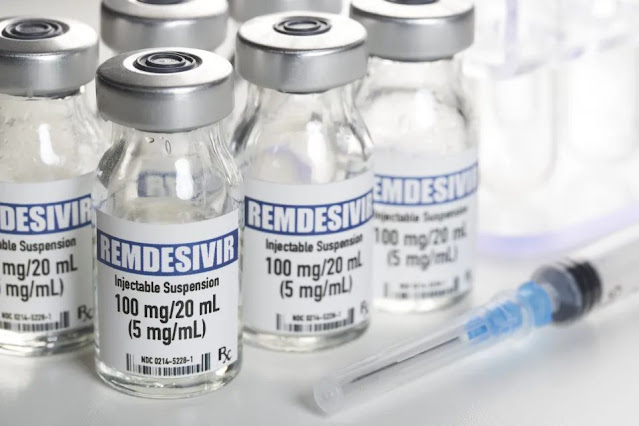
La società biofarmaceutica americana Gilead Sciences Inc. ha emesso un richiamo a livello nazionale di due lotti del suo farmaco per il trattamento del coronavirus Remdesivir a causa della "presenza di particelle di vetro", ha detto venerdì la società.
Remdesivir, conosciuto anche con il suo nome commerciale "Veklury", è normalmente usato per adulti e bambini sopra i 12 anni che richiedono l'ospedalizzazione per il covid-19, ed è normalmente dato in una vena per infusione endovenosa (IV) una volta al giorno per un massimo di 10 giorni.
"Gilead Sciences Inc. ha ricevuto un reclamo di un cliente, confermato dall'indagine dell'azienda, sulla presenza di particelle di vetro", ha detto in un comunicato.
"Un prodotto iniettabile che contiene particelle di vetro può provocare irritazione o gonfiore locale in risposta al materiale estraneo. Se il particolato di vetro raggiunge i vasi sanguigni può viaggiare verso vari organi e bloccare i vasi sanguigni nel cuore, nei polmoni o nel cervello che possono causare ictus e persino portare alla morte", ha aggiunto.
Ma Gilead ha notato che ad oggi non ha ancora "ricevuto alcuna segnalazione di eventi avversi legati a questo richiamo".
L'azienda californiana non ha risposto immediatamente a una richiesta di commento del Washington Post nel tardo pomeriggio di venerdì, ma il portavoce dell'azienda Chris Ridley ha detto a Bloomberg che il richiamo ha coinvolto circa 55.000 fiale del farmaco, abbastanza per trattare 11.000 pazienti ospedalizzati.
Il farmaco è normalmente "distribuito in fiale di vetro chiaro a dose singola in forma di polvere e ricostituito sul luogo d'uso", ha detto l'azienda. Le fiale richiamate sono state distribuite a livello nazionale negli Stati Uniti, a partire da ottobre 2021.
Remdesivir ha ottenuto l'autorizzazione all'uso di emergenza dalla Food and Drug Administration nel maggio 2020, con gli Stati Uniti che hanno acquistato gran parte della sua fornitura globale. È stato anche somministrato all'ex presidente Donald Trump quando era malato di covid-19. Nell'ottobre 2020 il farmaco antivirale è diventato il primo trattamento per il covid-19 a ricevere la piena approvazione della FDA.
La FDA ha delineato il suo uso per pazienti adulti, e pazienti pediatrici di 12 anni e più che pesano almeno 40 chilogrammi (circa 88 libbre), e ha detto che dovrebbe essere somministrato solo in un ospedale o in un ambiente sanitario.
Nel proprio studio l'anno scorso, Gilead ha detto che il suo farmaco ha portato a un "miglioramento del recupero clinico" da covid-19 e una riduzione del 62 per cento del rischio di morte rispetto ai pazienti che ricevono cure mediche standard, ma ha detto più studi clinici sono necessari.
Tra la nuova variante omicron coronavirus, l'azienda ha detto questa settimana si aspettava Remdesivir per "continuare ad essere attivo" contro la nuova variante e che avrebbe condotto test di laboratorio per confermare tale analisi.
Riportato su finance.yahoo.com

Posta un commento
Condividi la tua opinione nel rispetto degli altri. Link e materiale non pertinente sarà eliminato.